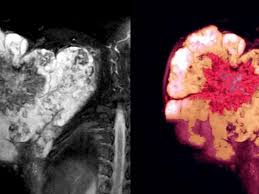
La Administración de Alimentos y Medicamentos de los EE. UU. aprobó Tecelra (afamitresgene autoleucel), una terapia genética indicada para el tratamiento de adultos con sarcoma sinovial irresecable o metastásico que han recibido quimioterapia previa, son positivos para los antígenos HLA A*02:01P, -A*02:02P, -A*02:03P o -A*02:06P y cuyo tumor expresa el antígeno MAGE-A4 según lo determinado por los dispositivos de diagnóstico complementarios autorizados por la FDA.
El sarcoma sinovial es una forma poco frecuente de cáncer en la que las células malignas se desarrollan y forman un tumor en los tejidos blandos del cuerpo. Este tipo de cáncer puede aparecer en muchas partes del cuerpo, siendo más común en las extremidades. Las células cancerosas también pueden propagarse a otras partes del cuerpo. Cada año, el sarcoma sinovial afecta a unas 1000 personas en los EE. UU. y se presenta con mayor frecuencia en varones adultos de 30 años o menos. El tratamiento generalmente implica cirugía para extirpar el tumor y también puede incluir radioterapia o quimioterapia si el tumor es más grande, vuelve a aparecer después de ser extirpado o se ha propagado más allá de su ubicación original.
“Los cánceres potencialmente mortales, como el sarcoma sinovial, siguen teniendo un impacto devastador en las personas, especialmente en aquellas para quienes los tratamientos estándar tienen una eficacia limitada debido al crecimiento y la progresión del tumor”, afirmó el Dr. Peter Marks, director del Centro de Evaluación e Investigación de Productos Biológicos (CBER) de la FDA. “La aprobación de esta tecnología de inmunoterapia de última generación ofrece una nueva opción fundamental para una población de pacientes necesitada y demuestra la dedicación de la FDA al avance de tratamientos beneficiosos contra el cáncer”.
Tecelra es también la primera terapia génica con receptor de células T (TCR) aprobada por la FDA. El producto es una inmunoterapia de células T autólogas compuesta por las propias células T del paciente. Las células T de Tecelra están modificadas para expresar un TCR que se dirige a MAGE-A4, un antígeno (sustancia que normalmente activa el sistema inmunológico) expresado por las células cancerosas en el sarcoma sinovial. El producto se administra en una dosis intravenosa única.
Tecelra fue aprobado utilizando la vía de Aprobación Acelerada , bajo la cual la FDA puede aprobar medicamentos para enfermedades o afecciones graves o potencialmente mortales en las que existe una necesidad médica no satisfecha y se demuestra que el medicamento tiene un efecto sobre un criterio de valoración indirecto que es razonablemente probable que prediga un beneficio clínico para los pacientes (mejorar cómo se sienten o funcionan los pacientes, o si sobreviven más tiempo). Esta vía puede permitir una aprobación más temprana mientras la empresa realiza más ensayos para verificar el beneficio clínico previsto. Se está llevando a cabo un ensayo confirmatorio para verificar el beneficio clínico de Tecelra.
“Los adultos con sarcoma sinovial metastásico, una forma de cáncer potencialmente mortal, suelen enfrentarse a opciones de tratamiento limitadas además del riesgo de propagación o recurrencia del cáncer”, afirmó la Dra. Nicole Verdun, directora de la Oficina de Productos Terapéuticos del CBER. “La aprobación de hoy representa un hito importante en el desarrollo de una terapia innovadora, segura y eficaz para pacientes con esta enfermedad rara pero potencialmente mortal”.
La seguridad y eficacia de Tecelra se evaluaron en un ensayo clínico abierto multicéntrico que incluyó a pacientes con sarcoma sinovial metastásico e inoperable que habían recibido terapia sistémica previa y cuyo tumor expresaba el antígeno tumoral MAGE-A4. La eficacia se evaluó en función de la tasa de respuesta general y la duración de la respuesta al tratamiento con Tecelra. Entre los 44 pacientes del ensayo que recibieron Tecelra, la tasa de respuesta general fue del 43,2 % y la duración media de la respuesta fue de seis meses.
Las reacciones adversas más comunes asociadas con Tecelra incluyeron náuseas, vómitos, fatiga, infecciones, fiebre, estreñimiento, disnea (dificultad para respirar), dolor abdominal, dolor de pecho no cardíaco, disminución del apetito, taquicardia (frecuencia cardíaca anormalmente rápida), dolor de espalda, hipotensión, diarrea y edema (hinchazón debido a la acumulación de líquido en los tejidos corporales).
Los pacientes tratados con Tecelra pueden experimentar el síndrome de liberación de citocinas (SLC), que es un tipo peligroso de respuesta agresiva del sistema inmunitario, que incluye reacciones potencialmente mortales. Se observó SLC tras la administración de Tecelra durante los ensayos clínicos. En la etiqueta se incluye un recuadro de advertencia que contiene información sobre este riesgo.
Los pacientes también pueden presentar el síndrome de neurotoxicidad asociada a células efectoras inmunitarias (ICANS), un síndrome relacionado con el sistema inmunitario que puede presentarse después de algunas inmunoterapias, infecciones, neoplasias malignas secundarias o reacciones de hipersensibilidad, y citopenia grave (un nivel anormalmente bajo de células sanguíneas) durante varias semanas después de la quimioterapia de depleción linfoide y la infusión de Tecelra. Los pacientes que reciben este producto deben ser monitoreados para detectar signos y síntomas de infección y se les recomienda no conducir ni participar en ocupaciones o actividades peligrosas durante al menos cuatro semanas después de recibir Tecelra.
La FDA otorgó a Tecelra las designaciones de medicamento huérfano , terapia avanzada de medicina regenerativa y revisión prioritaria para esta indicación.
Esta solicitud se revisó utilizando un enfoque coordinado entre agencias, incluido el CBER, el Centro de Excelencia Oncológica de la FDA y el Centro de Dispositivos y Salud Radiológica.
FOTO DE CUÍDATE PLUS